El enlace iónico es un tipo de enlace químico que presenta las siguientes características:
- Ocurre entre átomos de metal con no metal.
- Las electronegatividades de los elementos unidos son muy diferentes: el metal tiene electronegatividad muy baja y el no metal tiene electronegatividad muy alta.
- Los electrones de valencia (del último nivel) se transfieren del metal al no metal: el metal (poco electronegativo) tiende a perder electrones y el no metal (muy electronegativo) tiende a ganar electrones.
- Las partículas que se forman son iones: el metal se convierte en catión (+) al perder electrones; y el no metal se convierte en anión (-) al ganar electrones.
- La diferencia de cargas entre los átomos enlazados es muy grande: el metal queda con carga positiva y el no metal queda con carga negativa.
- Las sustancias con este tipo de enlace se denominan “compuestos iónicos” o “sales”.
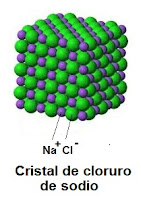
Ejemplo: enlace de un átomo de sodio y un átomo de cloro. El sodio es metal con 1 electrón de valencia y el cloro es no metal con 7 electrones de valencia.
En este enlace el sodio le cede su electrón de valencia al cloro. El sodio se convierte en catión (+) al perder un electrón; y el cloro se convierte en anión (-) al ganar un electrón. El enlace se forma por la atracción entre la carga positiva del sodio y la carga negativa del cloro.
Cuando se unen de esta manera numerosos iones de sodio y cloro se forma un cristal (no se forman moléculas).